چگونگی مرگ سلول های مغزی در اثر آلزایمر و FTD (زوال عقل لوب گیجگاهی)
دانشمندان کشف کردند که حذف ژن تنظیمکنندهی LSD1(lysine specific histone demethylase 1) در موشهای بالغ، باعث ایجاد تغییراتی میشود که بدون شک مانند بیماری آلزایمر است.
دانشمندان کشف کردند که حذف ژن تنظیمکنندهی LSD1(lysine specific histone demethylase 1) در موشهای بالغ، باعث ایجاد تغییراتی میشود که بدون شک مانند بیماری آلزایمر است. محققان همچنین کشف کردند که پروتئین LSD1 در نمونههای برداشته شده از بیماران دچار آلزایمر و FTD به صورت آشفته و درهم وجود دارد. بر اساس یافتههای ایشان در انسان و موشهای بیمار، تیم تحقیقاتی نقش LSD1 را نقش اصلی در بیماری های تخریبگر نورون(neurodegenerative) دانسته و آن را یک هدف دارویی در نظر میگیرند.
یافتههای این محققین در نوبت چاپ نشریهی Nature Communications قرار گرفته است.
در مغز LSD1 در میان ژنهایی که باید خاموش باشند، ساکت می ماند. هنگامی که محققان موشهایی را مهندسی کردند که در دوران بلوغ، ژن LSD1 در آنها وجود نداشت، موشها به لحاظ شناختی ضعیف و فلج میشدند. بسیاری از نورونها در مغز موشهای فاقد LSD1 در حال مرگ بودند، در حالی که باقی اندامها سالم به نظر رسیده و کارایی خود را حفظ میکردند. با این حال به نظر میرسد آنها دچار کمبود پروتئینهای تجمعی در مغز شده باشند، همانند همان عواملی که به نظر باعث آلزایمر و FTD می شده است.
دکتر دیوید کاتز، استادیار بیولوژی سلولی در Emory University، میگوید:" در موشها ما بدون تمرکز بر پروتئینهای تجمعی، که به عنوان عامل شروع زوال عقل در گرفته می شوند، مستقیماً به سراغ اثرهای پایین دستی می رویم."
آزمایشگاه کاتز برای تولید موشهای دچار بیماریهای تخریبگر نورون برنامهریزی نشده بود. به نظر می رسید LSD1 عاملی حیاتی در مراحل اولیهی پرورش جنینی باشد، و همچنین او و همکارانش جذب نقش این پروتئین در تولید اسپرم شده بودند.
هنگامی که محققان به الگوهای فعالیتهای ژنی تغییر یافته در موشهای فاقد LSD1 نگاهی انداختند، متوجه نشانههایی از التهاب و تغییراتی دیگر در متابولیسم سلولی و سیگنالی شدند. این تغییرات مشابه تغییراتی بودند که قبلاً در بیماران دچار آلزایمر و FTD مشاهده شده بود، ولی نه در بیماران پارکینسون و یا ALS.
یافتههای جالب تر هنگامی به دست آمد که بافتهای مغزی نمونه برداری شده از آلزایمر و FTD مورد بررسی قرار گرفتند. این بررسی ها با همکاری دکتر آلان لوی ، مدیر مرکز تحقیقات بیماری آلزایمر Emory ، صورت گرفت.
لوی میگوید:" ما از دیدن انباشتگی LSD1 در پیچیدگیهای نوروفیبریلاری در بیماران آلزایمر و در تجمعاتTDP-43 در بیمارات FTD شگفت زده شدیم. در هردو بیماری پروتئینLSD1 به همراه این پاتولوژیها در سیتوپلاسم تجمع یافته بود. از آن جایی که LSD1 به صورت نرمال در هسته قرار میگیرد، این یافتهها می توانند سرنخ هایی به ما بدهند که چطور ممکن است این پدیده به تخریب نورونی انتخابی و در عین حال شدید مرتبط باشد، همانند آن چیزی که ما در موشهای فاقد LSD1 مشاهده کرده بودیم، در همان مناطق کورتکس و هیپوکامپال مغزی، که به عنوان مناطق حساس در این دو بیماری شناخته شده اند."
LSD1 به عنوان یک مجری اپی ژنتیک عمل میکند.
LSD1 نشانههای اپی ژنتیک روی هیستونها، پروتئینهایی که DNA را دسته بندی میکنند، را پاک میکند. در این شرایط اپی ژنتیک به اطلاعاتی گفته میشود که مشخصاً در DNA حمل نمیشوند، چرا که این علامات فعالیتهای ژنهایی مرتبط با این دسته بندی تغییر یافته را تحت تاثیر قرار میدهند. LDS1 در دوران برنامه سازی های مجدد دوره جنینی بسیار مهم است، هنگامی که ژنهای اسپرم و تخمک با محیط جدید خود، در تخمک تازه بارور شده، تطابق پیدا میکنند. دید عمومی این است که نورونها و دیگر سلولهای تمایز یافته، به سرنوشتشان متعهد هستند و نمیتوانند آن را تغییر دهند. نویسندگان این مقاله معتقدند که LSD1 با سرکوب کردن ژنهایی که در سلولهای دیگر فعال هستند مسئول ایجاد این تعهد است.
هنگامی که LSD1 از سلول خارج شود، فعالیتهای ژنی در نورنها کمی به هم میریزد. برای مثال آنها تعدادی از ژنهایی که در سلولهای جنینی فعال هستند، را روشن میکنند. به نظر میرسد نورونها بیشتر از سلولهای عضلانی، کبدی، کلیوی و دیگر بافتها، به حذف شدن LSD1 حساس هستند، چرا که سلولهای بافتهای غیر عصبی در اثر نبود این ژن دچار مرگ و میر نمیشوند.
کاتز معتقد است که فعال کردن دوبارهی ژنهای فعال دورهی جنینی(پایه)، تنها بخشی از مشکل است: به نظر میرسد نبود LSD1 باعث ایجاد ترکیبی از استرسها میشود که این استرسها بازتاب کنندهی استرسهای مشاهده شده در آلزایمر و FTD هستند. LSD1 پیش از این به بیماریهای تخریبگر نورون ارتباط داده نشده بود، بنابر این کاتز میگوید با شک و تردید هایی در این زمینه مواجه شدهایم.
او میگوید:" اگر ما فقط سلولهای مغزی را میکشتیم، انتظار نداشتیم شاهد الگوهایی باشیم که بسیار شبیه الگوهای مشاهده شده در افراد بیمار باشند. همچنین انتظار نداشتیم که LSD1 لزوماً در بیماران انسانی تحت تاثیر قرار گرفته باشد."
تیم تحقیقاتی کاتز همچنان به یافتن حلقههای ارتباط LSD1 به بیماری آلزایمر و FTD ، مانند پروتئین تاو، که جزء اصلی پیچیدگیها محسوب میشود، ادامه میدهند. او میگوید این تحقیقات پتانسیل آن را دارد که داروهایی معرفی کند که با بیماریهای تخریبگر نورون مبارزه کنند، ترکیباتی که برهمکنش LSD1 با در همتنیدگی های نوروفیبریلاری را متوقف کند، یا فعالیت LSD1 را تقویت کند.
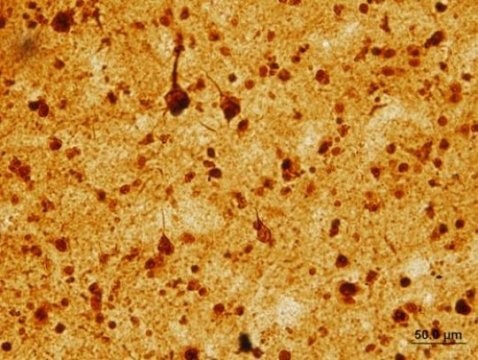
تصویر رنگ آمیزی شده LSD1 که از مغز یک فرد دچار آلزایمر گرفته شده، الگوهایی مشابه پروتئین تاو را شبیه سازی می کند.
منبع: www.sciencedaily.com


نوشته های مرتبط