دانشمندان مدل جدیدی از سیگنالدهی مغزی ارائه کردهاند
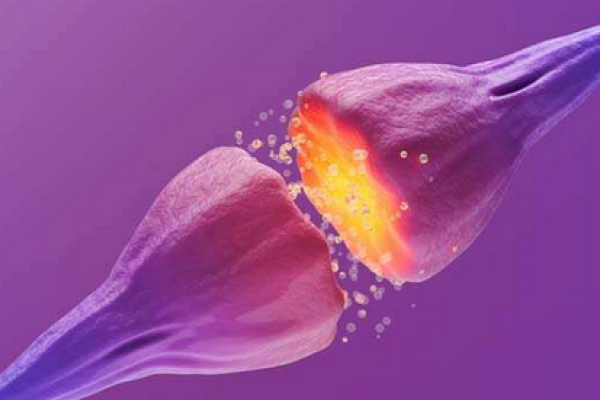
آزاد شدن انتقال دهندههای عصبی و هورمونها در بدن، به وسیلهی یک سیستم پروتئینی پیچیده که در غشای سلولی قرار گرفته، کنترل میشود.
آزاد شدن انتقال دهندههای عصبی و هورمونها در بدن، به وسیلهی یک سیستم پروتئینی پیچیده که در غشای سلولی قرار گرفته، کنترل میشود.
تغییر دادن این سیستم به وسیلهی داروها میتواند درمان برخی اختلالات از دیابت گرفته تا پارکینسون را بهبود ببخشد. پیشرفت علم در این زمینه کند بوده است، آن هم به دلیل کمبود مدلهای حیوانی برای آزمودن اثرات داروهای پیشنهادی، اما اکنون وضعیت تغییر کرده است.
هفته گذشته، داروساز دانشگاه وندربیلت، Heidi Hamm و همکارانش اولین مدل حیوانی یک مکانیزم مهم فیدبک را ارائه کرده اند. این مکانیزم یک دریچه قطع کننده برای انتقال دهندههای عصبی و هورمونهاست که از طریق اثر گذاری بر فیوژن غشای پیچیدهی واسطه SNARE عمل میکند.
در مقالهای محققان گزارش کرده اند که هنگامی که دریچهی قطع کننده در سلولهای عصبی مغز موشها را (با استفاده از تغییرات ژنتیکی) از کار انداختند، نقصهای قابل توجهی در هماهنگی حرکتی، فعالیتهای شناختی و رفتاری حیوان بروز پیدا کرد.
دانشمندان میدانند که چگونه SNARE را تنظیم کرده، و فعالیت انتقال دهندههای عصبی را کنترل کنند. اما تا کنون نمیدانستند که در صورت انجام این کار، چه اتفاقی رخ خواهد داد.
Hamm میگوید: ما اکنون با داشتن مدل حیوانی، میتوانیم این مکانیزم را به صورت جامع تری بررسی کنیم. چیزهای زیادی که پیش از این امکان بررسی و پژوهش در آن وجود نداشت، حال در دسترس هستند.
Hamm در طول زمان فعالیت خود در دانشگاه وندربیلت، چندین کشف مهم در رابطه با گیرندههای مزدوج پروتئین G (GPCR) داشته است. این گیرندهها که تقریبا در تمامی سلولها وجود دارند، رایج ترین مجرا برای مسیرهای سیگنال دهی هستند که در طبیعت پیدا شده. بیش از 60 درصد داروها این گیرندهها را هدف قرار میدهند.
GPCRها به وسیلهی پروتئینهای G درون سلول، روشن و خاموش میشوند. پروتئینهای G از دو قسمت تشکیل میشوند، آلفا و بتا/گاما، که هردوی اینها میتوانند به طور مستقل مسیرهای سیگنال دهی را تحریک کنند.
چندین سال پیش، Hamm و همکارانش، از جمله Simon Alford ، نشان دادند که قسمتهای بتا/گامای یک پروتئین G مهار کننده، از ترکیب شدن وزیکولهای حاوی انتقال دهندههای عصبی، با غشای سلول، و آزاد سازی این انتقال دهندهها درون فضای بین سلولی نورونها (سیناپسها) جلوگیری میکنند.
این اتفاق به دو صورت متفاوت رخ میدهد: با جلوگیری از جریان یافتن کلسیم از طریق کانالهای کلسیمی (جلوگیری از ترکیب شدن وزیکولها با غشا) و دیگری به وسیلهی خاموش کردن مجموعه گیرندهی SNARE.
Hamm میخواست بداند که چرا دو مکانیزم متفاوت برای مهار آزاد سازی انتقال دهندههای عصبی وجود دارد. او میگوید: ما تنظیمات آزاد سازی از طریق SNARE را در کشتهای سلولی به طور کامل مورد بررسی قرار دادیم. اما نمیدانستیم که در یک ارگانیسم زنده، این عمل چگونه انجام میشد.
با استفاده از یک فناوری جدید برای تغییر ژنوم، به نام CRISPR/Cas9، Zack Zurawski، که در آن زمان دانشجو بود، جهشی در سلولها به وجود آورد که به قسمتهای بتا/گاما اجازه نمیداد که سیستم SNARE را خاموش کنند.
Hamm میگوید: شگفت آور است که اولین تلاش ما برای انجام اینکار به نتیجه رسید. معمولا برای تولید چنین موشهایی دو یا سه سال زمان لازم است، و ما این کار را در سه ماه انجام دادیم. این امر واقعا یک دستاورد بزرگ بود.
محققان همچنین کشف کردند که این دو مکانیزم برای جلوگیری از ترکیب شدن وزیکولها با غشا (یکی با اثر روی کانالهای کلسیمی، و دیگری با اثر بر SNARE) با یکدیگر همکاری کننده (سینرژیستیک) هستند. بلوکه کردن فعالیت هر دوی این مکانیزمها، اثر شدیدتری، نسبت به حالت بلوکه کردن تنها یک مکانیزم، ایجاد میکند.
Hamm میگوید: من فکر میکنم که این بدان معناست که این دو مکانیزم متفاوت، احتمالا بسیار مهم تر از آن چیزی هستند که مردم فکر میکنند.
منبع: مدیکال اکسپرس



نوشته های مرتبط